Zadanie z bazy wiedzy
Dzień dobry, w jaki sposób obliczyć tutaj ciepło oddane?
Ciepło oddane Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Dziękuje bardzo, już myślałem, że coś przeoczyłem
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Jeszcze jedno pytanie:
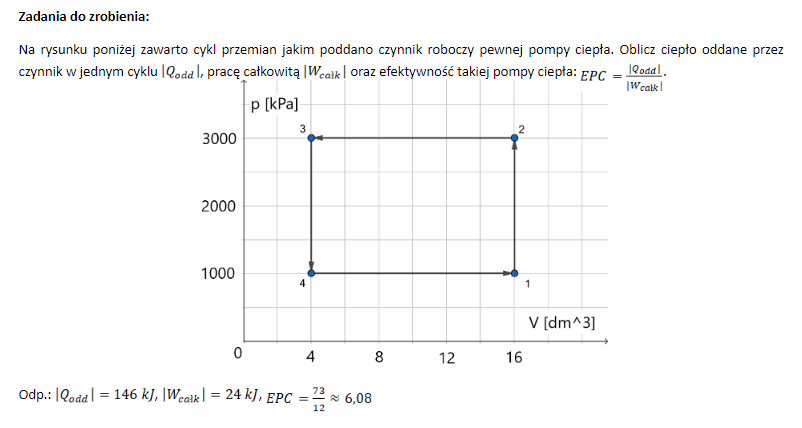
w przemianie 2 - 3 Q = -126kJ a praca wykonana nad gazem to 36kJ
czy nie trzeba tu zastosowac 1 zasady termodynamiki deltaU = Qodd + W więc wychodziłoby że Qodd = -126kJ - 36kJ =-162kJ
czy zmiana energi wewnętrznej gazu nie równa się tutaj 126 kJ?
W przemianie 3 - 4 nie ma pracy wykonanej nad gazem więc deltaU = Qodd = -20 kJ
W skrócie czy zmiana energii wewnętrznej gazu nie równa się ciepłu jakie trzeba odebrac od gazu aby ochłodzic go o deltaT?
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Jak najbardziej można zastosować I zasadę termodynamiki, przy czym trzeba koniecznie pamiętać, że W, które się w niej pojawia (tak jak jest zapisana w karcie wzorów) to właśnie praca wykonana nad gazem! Czyli trzeba te 36 kJ wrzucić ze znakiem plus. Dostaniemy wtedy (w tej przemianie 2-3): deltaU = Q + W = -126 kJ + 36 kJ = - 90 kJ
Czyli w przemianie 2-3 energia wewnętrzna zmalała o 90 kJ.
Co do przemiany 3-4 to Twoje obliczenie jest już ok, w istocie deltaU = Q = -20 kJ.
Ale ostatnie stwierdzenie nie zawsze jest prawdziwe. Mianowicie zawsze prawdą jest, że deltaU = n* cv * deltaT, niezależnie od przemiany (wyprowadzaliśmy nawet ten wzór na zajęciach - bardzo przydatna formuła). A zatem zapisane przez Ciebie ostatnie zdanie jest prawdziwe tylko w przemianie izochorycznej, bo w niej nie ma wykonanej pracy. W pozostałych przemianach zgodnie z I zasadą termodynamiki deltaU = Q + W (sumujemy ciepło i pracę). Natomiast jak wspomniałem zawsze, w każdej przemianie, prawda jest, że deltaU = n* cv * deltaT. Jeśli tak policzysz to w przemianie 2-3 to wyjdzie Ci poprawnie, że w tej przemianie deltaU = - 90 kJ.
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Ooops, wygląda na to, że w treści zabrakło informacji o tym z jakim gazem mamy do czynienia (tzn. np. z ilu atomów składa się cząsteczka tego gazu, czy też po prostu ile wynosi np. cv - ciepło molowe przy stałej objętości - dla tego gazu). W przypadku tego gazu cv = 5/2 R. Jeśli mamy tę informację, to wtedy już możemy to policzyć. Jak to zrobić? Należy zwrócić w pierwszej kolejności uwagę na fakt, że mamy tu tylko przemiany izochoryczne i izobaryczne, a w ich przypadku ciepło obliczamy ze wzorów Q = n*cv*deltaT (izochoryczna) oraz Q = n*cp*deltaT (izobaryczna). DeltaT w obu przypadkach wyznaczymy z równania Clapeyrona: pV = nRT, zatem T = pV/nR, więc deltaT = delta(pV)/nR. Ciepło jest oddawane tylko w przemianach 2-3 i 3-4, więc sumujemy ciepła z tych przemian, aby obliczyć Qoddane. delta(pV) to po prostu zmiana wartości iloczynu p*V w danej przemianie (czyli np. w przemianie 3-4 wynosi ona 8000 J, bo jest to 12000 J - 4000 J).